- 36
- 0
Алгоритм выбора смесей для детей с синдромом Швахмана-Даймонда на искусственном вскармливании: итоги клинического исследования российских специалистов
Особенности физического развития при рождении и алгоритм выбора смеси у детей с синдромом Швахмана — Даймонда, находящихся на искусственном вскармливании»
Цель. Изучить особенности физического развития при рождении у детей с генетически подтвержденным диагнозом синдрома Швахмана — Даймонда (СШД) и сопутствующей аллергией на белки коровьего молока (БКМ).
Дизайн. Ретроспективное и проспективное лонгитудинальное исследование.
Материалы и методы. В исследование включены 74 ребенка с генетически подтвержденным диагнозом СШД. У всех детей с СШД оценивали антропометрические данные, выраженные в виде стандартных отклонений от нормативных значений, соответствующих полу, а также календарному и биологическому возрасту. Для детей, находившихся на искусственном вскармливании, подбирали смеси с учетом выявленной аллергии на БКМ на основе гидролизата со среднецепочечными триглицеридами (СЦТ) или на основе аминокислот.
Результаты. Задержка внутриутробного развития наблюдалась у 9 (12,2%) детей с СШД. У 44 (59,5%) детей ведущим симптомом на первом году жизни был атопический дерматит. У 37 (50%) детей с атопическим дерматитом при ведении пищевого дневника родители выявили связь кожных высыпаний с БКМ. Повышение уровня специфического иммуноглобулина E на БКМ выявлено лишь у 7 (9,5%) детей. При оценке физического развития и кожных проявлений через 6 месяцев на фоне лечебного питания и ферментозаместительной терапии панкреатином в минимикросферах у пациентов с СШД отмечались стойкая положительная динамика прибавки массы тела в месяц (Ме — 582 [512; 664] г, р = 0,0464) и купирование атопического дерматита.
Заключение. При аллергии на БКМ у детей с врожденной экзокринной недостаточностью, находящихся на искусственном вскармливании, требуется назначение специализированного лечебного питания (смеси на основе гидролизата БКМ с СЦТ или на основе аминокислот). Мы разработали алгоритм выбора смеси у детей с СШД, что позволило нам купировать клинические проявления аллергии на БКМ, провести коррекцию белково-энергетическая недостаточности (р = 0,0464) и снизить дозу панкреатина в минимикросферах (р = 0,0433).
ВВЕДЕНИЕ
Синдром Швахмана — Даймонда (СШД, Shwachman — Diamond syndrome) — это редкое аутосомно-рецессивное заболевание, характеризующееся нарушением гемопоэза (нейтропенией, тромбоцитопенией, анемией или панцитопенией), иммунодефицитом, экзокринной недостаточностью поджелудочной железы (ПЖ), костными аномалиями и задержкой физического развития[1, 2]. В основе заболевания лежат биаллельные патогенные варианты в гене SBDS, которые ведут к изменению биогенеза и/или нарушению функций рибосом[3, 4].
У большинства пациентов клинические проявления СШД возникают с первых недель жизни в виде стеатореи, плохой прибавки массы тела, задержки роста и физического развития[5–9]. При отсутствии адекватной нутритивной и медикаментозной коррекции развивается белково-энергетическая недостаточность различной степени тяжести[9–14].
В настоящее время существуют единичные работы по оценке физического развития пациентов с СШД при рождении[7, 10, 11, 14]. Не выявлена корреляция патогенных вариантов в гене SBDS с физическим развитием при рождении у детей с СШД. Мы также не нашли публикации о наличии пищевой аллергии/непереносимости у пациентов с СШД как фактора, влияющего на физическое развитие детей 1-го года жизни.
Цель исследования: изучить особенности физического развития при рождении у детей с генетически подтвержденным диагнозом СШД и сопутствующей аллергией на белки коровьего молока (БКМ).
МАТЕРИАЛЫ И МЕТОДЫ
На базах ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва» Минздрава России, ГБУЗ «ДГКБ им. Н.Ф. Филатова ДЗМ», Российской детской клинической больницы — филиала ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России проводилось ретроспективное и проспективное лонгитудинальное исследование с участием 74 пациентов с генетически подтвержденным диагнозом СШД (биаллельными патогенными вариантами в гене SBDS), наблюдавшихся с 2010 по 2023 г. Проведение исследования одобрено независимым локальным этическим комитетом ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (протокол № 206 от 22.03.2021 г.).
Ретроспективная оценка физического развития при рождении осуществлялась с учетом гестационного возраста, пола и антропометрических данных (массы тела, роста) и их Z-scores с помощью компьютерной программы INTERGROWTH-21 и электронного калькулятора роста INTERGROWTH-21.
Для изучения экзокринной функции ПЖ определяли активность фекальной эластазы 1 методом иммуноферментного анализа при помощи диагностических наборов Elastase 1 stool test, ScheBo Biotech (Schülke & Mayr GmbH, Германия) и ELV99200220 (BioServ Diagnostic, Германия). Референсные значения: > 200 мкг/г кала. Снижение активности эластазы 1 в стуле от 100 до 200 мкг/г кала свидетельствует об умеренной степени экзокринной недостаточности ПЖ, значения < 100 мкг/г кала указывают на тяжелую степень панкреатической недостаточности.
У всех детей определялись специфические IgE-антитела к БКМ как фактору, который может усугублять нутритивную недостаточность у пациентов с СШД. Для оценки концентраций специфических IgE-антител к пищевым продуктам использовали хемилюминесцентный метод, включающий биотинилированные аллергены и твердую фазу с частицами авидина (анализатор IMMULITE Siemens AG, Германия). Референсные значения — менее 0,1 Е/л. Лабораторные исследования проводились по стандартным методикам с применением наборов, согласно инструкции производителя.
Генетические исследования выполнены в лаборатории молекулярной биологии и лаборатории цитогенетики. У всех пациентов проводилось молекулярно-генетическое исследование патогенных вариантов в гене SBDS: у 62 (83,8%) детей методом прямого секвенирования по Сэнгеру, у 12 (16,2%) — методом секвенирования нового поколения (next generation sequencing), панель «Костномозговая недостаточность».
Для детей, находившихся на искусственном вскармливании, подбиралась смесь с учетом аллергии/непереносимости БКМ.
Статистический анализ полученных данных производили с помощью пакета программ SPSS 26.0 (IBM) и среды для статистических вычислений R 4.2.1. Качественные переменные представлены в виде числа наблюдений (относительной частоты) и процентов, количественные — медианой, 1-м и 3-м квартилями (Me [Q1; Q3]); приведены минимальное и максимальное значения (min–max). Оценку нормальности распределения количественных показателей проводили на основе анализа описательной статистики и теста Шапиро — Уилка. Полученные результаты считались статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
В исследование включены 74 ребенка с генетически подтвержденным диагнозом СШД — 34 (45,9%) мальчика и 40 (54,1%) девочек.
Средний возраст пациентов, у которых генетически подтвержден диагноз СШД, составил 4,6 года, Мe — 2,2 [1,3–7,5] года, минимальный — 4 месяца, максимальный — 17,2 года. Следует отметить, что возраст постановки диагноза около 4 месяцев был в шести семьях, где у старших сибсов уже диагностировали СШД.
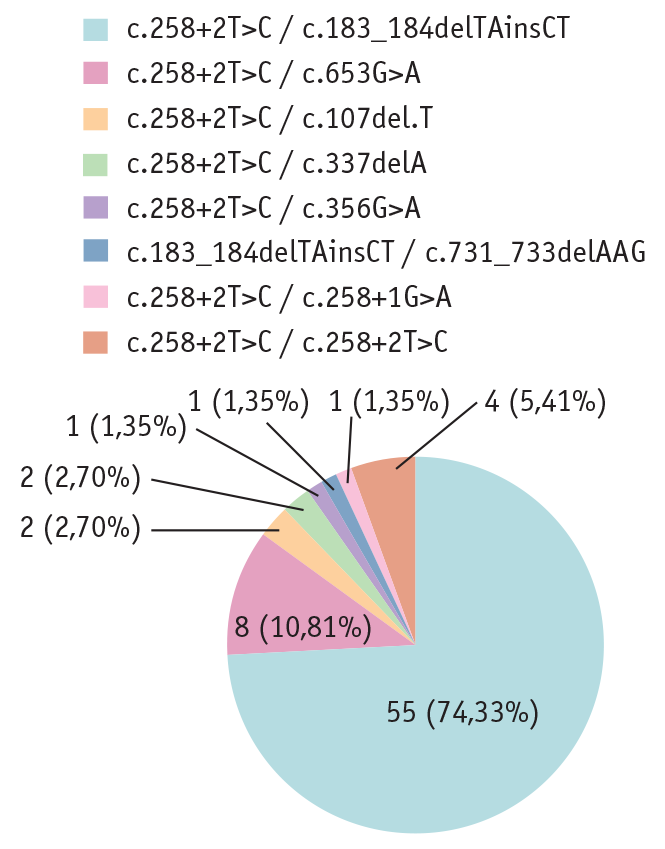
У пациентов с СШД обнаружены 8 патогенных вариантов в гене SBDS. Как показано на рисунке 1, у 55 детей патогенный вариант с.258+2T>C в компаунд-гетерозиготной форме сочетался с вариантом c.183_184delTAinsCT, у 8 пациентов — с c.653G>A, по 2 случая — с c.107del.T, c.337delA, по одному случаю — с c.258+1G>A и с.356G>A. У одного ребенка патогенный вариант c.183_184delTAinsCT оказался с делецией участка экзона и интрона с.731_733delAAG. У четырех детей патогенный вариант с.258+2T>C был в гомозиготном состоянии.
Рис. 1. Сочетания различных патогенных вариантов в гене SBDS у пациентов с синдромом Швахмана — Даймонда (n = 74)
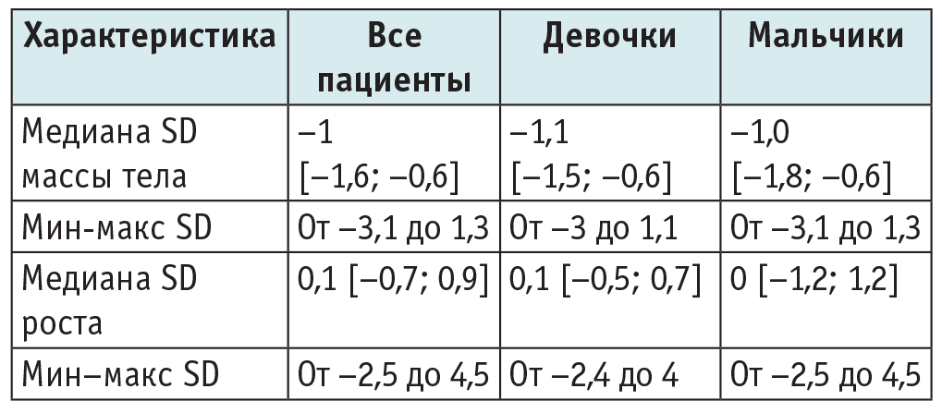
Средний срок гестации, на котором родились дети с СШД, составил 39 недель, 5 (6,8%) детей родились на сроке 35–36,5 недели (Мe — 39,1 [38,2; 40]). При рождении Мe массы тела составляла 2972 [2640; 3180] г, Мe роста — 50 [48; 52] см. Мe SD роста при рождении — 0,1 [–0,7; 0,9], Мe SD массы тела при рождении — –1 [–1,6; –0,6]. Мe SD роста при рождении у девочек составила 0,1 [–0,5; 0,7], у мальчиков — 0 [–1,2; 1,2]. Мe SD массы тела при рождении у девочек была –1,1 [–1,5; –0,6], Мe SD массы тела у мальчиков — –1,0 [–1,8; –0,6]. Таким образом, для детей с СШД нехарактерна задержка роста при рождении (Мe SD — 0,1), однако отмечена тенденция дефицита массы тела (Мe SD — –1) независимо от пола.
Задержка внутриутробного развития (ЗВУР) — отставание в массе или росте более чем на 2 SD при рождении — выявлена у 9 (12,2%) детей с СШД. Антропометрические данные при рождении представлены в таблице 1.
Таблица 1. Антропометрические данные пациентов с синдромом Швахмана — Даймонда при рождении (n = 74), Me [Q1; Q3]
Возраст детей на момент дебюта заболевания в виде симптомов экзокринной недостаточности ПЖ (частый жирный стул, плохая прибавка массы тела, стеаторея, по данным копрологического исследования) составил от 1 недели жизни до 4,3 месяца (Me — 1,5 [0,5; 3,0] месяца). Помимо стеатореи, у родителей/законных представителей были жалобы на плохую прибавку массы (140–420 г в месяц) у 51 (68,9%) пациента.
В связи с жалобами на стойкую стеаторею у всех детей определяли активность эластазы 1 в кале. Снижение активности эластазы 1 (< 200 мкг/г) выявлено у 73 (98,7%) детей с СШД, медиана составила 24 [15; 53,5] мкг/г. Только у одного ребенка с патогенными вариантами с.183_184delТАinsCT и с.258 + 2T>C в гене SBDS активность эластазы 1 оказалась более 200 мкг/г. Таким образом, почти у всех детей с СШД имела место экзокринная недостаточность ПЖ, что требовало назначения ферментозаместительной терапии панкреатином в минимикросферах (средняя доза — 5,97 ± 2,47 липазных единиц/кг/сутки, разделенная на кратность приема пищи).
С рождения до 3 месяцев грудное вскармливание получал 21 (28,4%) ребенок, до 6 месяцев — 10 (13,5%), более 6 месяцев — 35 (47,3%) детей. На искусственном вскармивании с рождения были 8 (10,8%) детей. В случае перевода ребенка из-за гипогалактии матери с грудного на искусственное вскармливание адаптированной молочной смесью Формула 1 у 44 (59,5%) пациентов с СШД появлялся атопический дерматит. Как сказано выше, только у 6 детей с СШД диагноз выставили в возрасте около 4 месяцев в связи с наличием данного заболевания у старших сибсов. Остальные дети наблюдались педиатрами с диагнозом пищевой аллергии на БКМ, несмотря на наличие стеатореи с первых дней жизни. Следует также отметить, что только у 6 (8,1%) детей был отягощенный семейный аллергоанамнез.
Хотя у 44 (59,5%) наблюдаемых детей ведущей жалобой при обращении к педиатру на первом году жизни стал атопический дерматит, при аллергологическом обследовании уровень специфического IgE на БКМ был повышен лишь у 7 (9,5%) пациентов. У 37 (50%) детей с атопическим дерматитом аллергологическое исследование не выявило увеличение концентрации специфических IgE-антител к БКМ, однако при ведении пищевого дневника родители зафиксировали связь кожных высыпаний с БКМ.
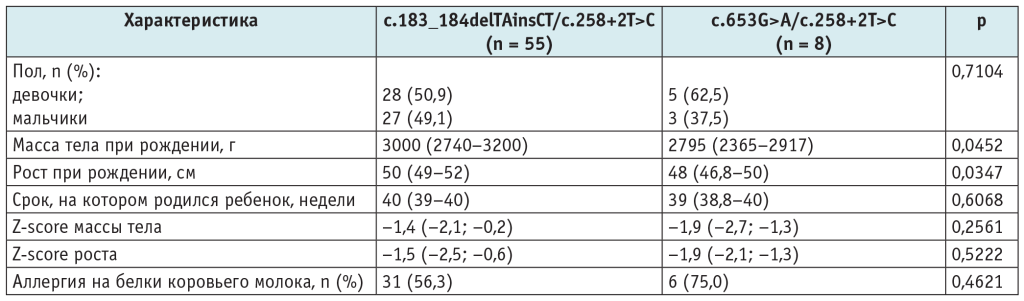
Мы решили проанализировать антропометрические характеристики пациентов и наличие пищевой аллергии на БКМ в зависимости от генотипа. Как показано в таблице 2, у детей с генотипом c.653G>A/с.258+2T>C значимо более низкие масса тела и рост при рождении (р = 0,0452 и р = 0,0347).
Таблица 2. Антропометрические характеристики и наличие аллергии на белки коровьего молока у пациентов в зависимости от генотипа
Пациентам, находившимся на искусственном вскармливании Формулой 1, с выявленной аллергией/непереносимостью БКМ рекомендован переход на смеси на основе высокогидролизованных белков молочной сыворотки (ВГС) или на основе аминокислот (АК), содержащие в составе жирового компонента среднецепочечные триглицериды (СЦТ). Обогащение смеси СЦТ существенно повышает усвояемость жирового компонента формулы, так как не требует участия липазы ПЖ, а олигопептиды, в том числе молекулярной массой менее 1200 Дальтон (Да), абсорбируются быстрее и лучше, чем интактные белки, и практически не требуют участия ферментных систем для всасывания в тонкой кишке[15, 16]. Это позволило снизить дозу панкреатических ферментов до 3,66 ± 1,22 ЛЕ/кг/сут. (р = 0,0433).
В данном исследовании смесь на основе ВГС с добавлением СЦТ (ВГС + СЦТ) Альфаре Гастро получали 34 ребенка, смесь на основе АК Альфаре Амино — 10 детей, длительность приема — не менее 6 месяцев. При наличии атопического дерматита дополнительно рекомендована наружная терапия эмолентами.
Энергетическая ценность 100 мл готовой смеси Альфаре Гастро составляет 67 ккал, она содержит только сывороточный белок (1,9 г) с максимальным уровнем гидролиза (99% пептидов < 1,2 kДа), жиры — 3,4 г, на 40% представленные СЦТ, — источник легкодоступной энергии для ребенка[15]. В смеси Альфаре Амино (АК) энергетическая ценность 100 мл — 66 ккал, смесь содержит 1,8 г белкового эквивалента в виде АК и 3,3 г жиров, на 24% представленных СЦТ.
Преимуществом данных смесей является обогащение комплексом олигосахаридов 2’-фукозиллактозой и лакто-N-неотетраозой, структурно идентичных олигосахаридам грудного молока и способных модулировать иммунный ответ, улучшать барьерную функцию кишечника, ингибировать адгезию патогенных микроорганизмов и стимулировать рост полезной микробиоты[17–21].
Предлагаем алгоритм подбора смеси у детей с СШД, находящихся на искусственном вскармливании (рис. 2).
Рис. 2. Алгоритм подбора смеси у детей 1 года с синдромом Швахмана — Даймонда (СШД), находящихся на искусственном вскармливании. Адаптировано из клинических рекомендаций «Пищевая аллергия», пересмотра 2024 года (https://portalcr.minzdrav.gov.ru/viewCR/1904)
* Доза панкреатина в минимикросферах 5,97 ± 2,47 ЛЕ/кг/сут.
** Доза панкреатина в минимикросферах 3,66 ± 1,22ЛЕ/кг/сут.

При оценке физического развития и кожных проявлений через 6 месяцев на фоне лечебного питания и ферментозаместительной терапии панкреатином в минимикросферах у пациентов с СШД отмечались стойкая положительная динамика прибавки массы тела в месяц (Ме — 582 [512; 664] г, р = 0,0464) и купирование атопического дерматита. В дальнейшем родителям пациентов рекомендовано ввести гипоаллергенный прикорм и продолжить ведение пищевого дневника.
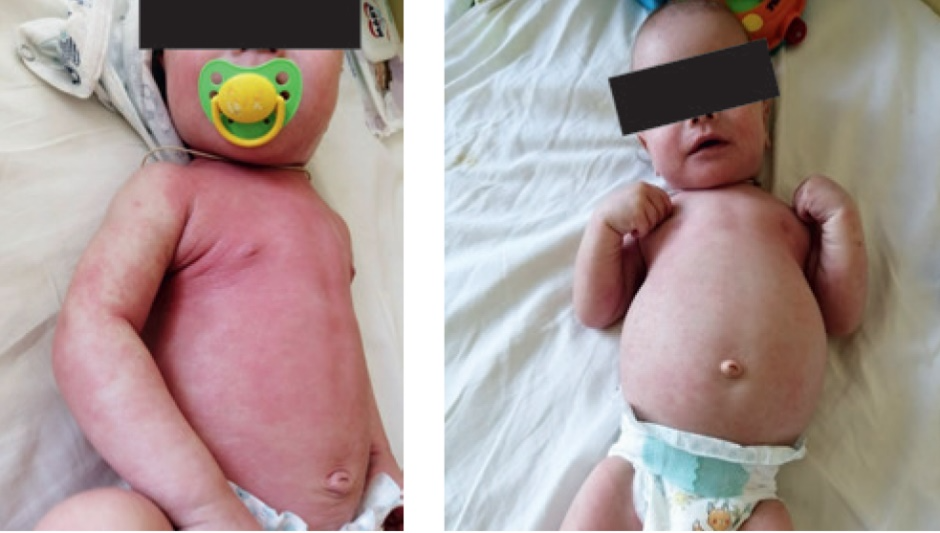
На рисунке 3 показан ребенок с СШД и атопическим дерматитом, распространенной формой, в возрасте 2 месяцев на фоне приема адаптированной молочной смеси Формула 1 и через 2 недели после перевода на смесь ВГС + СЦТ.
Рис. 3. Ребенок с синдромом Швахмана — Даймонда и атопическим дерматитом в возрасте 2 месяцев на фоне приема смеси Формула 1 и через 2 недели после перевода на смесь на основе высокогидролизованных белков молочной сыворотки с добавлением среднецепочечных триглицеридов. Иллюстрация авторов
ОБСУЖДЕНИЕ
В обследованной нами группе с генетически подтвержденным диагнозом СШД большинство детей родились в срок (Мe — 39,1 [38,2; 40] недели), с нормальными массо-ростовыми показателями (Мe массы тела — 2972 [2640; 3180] г, Мe роста — 50 [48; 52] см). Только 5 (6,8%) детей родились на сроке 35–36,5 недели гестации, ЗВУР выявлена лишь у 12,2% пациентов с СШД.
В исследовании K.C. Myers и соавт. (2013), включавшем 15 детей с СШД, 80% родились доношенными, с массой и ростом, соответствующими гестационному возрасту[14]. В исследовании X. Han (2023) из 84 пациентов с СШД 62 (73,8%) родились доношенными и 22 (26,2%) — недоношенными[10]. Таким образом, в нашем исследовании дети с СШД рождались недоношенными несколько реже, чем в исследованиях указанных авторов[10, 14].
При анализе антропометрических данных при рождении у детей с СШД нами не выявлена задержка роста при рождении (Мe SD — 0,1), однако отмечена тенденция к дефициту массы тела (Мe SD — –1) независимо от пола.
В исследовании K.C. Myers и соавт. средняя масса тела при рождении составила –1,2 SD (от – 1,9 до 0,7 SD) у мальчиков и –0,7 SD (от –1,7 до 1,5 SD) у девочек[14].
Аналогичные данные получены в работе A. Bogusz-Wójcik и соавт.: средний рост детей при рождении был –1,4 SD (от –1,7 до –0,6 SD) у мальчиков и –0,95 SD (от –1,7 до +0,1 SD) у девочек, а средний срок беременности, на котором родились пациенты, составил 39 (33–41) недель[8]. Возможно, некоторое расхождение данных обусловлено соматическим, гинекологическим и акушерским анамнезом матерей, который не анализировали в опубликованных работах.
При изучении антропометрических данных пациентов в зависимости от генотипа мы выявили значимо более низкие массу тела и рост при рождении у детей с генотипом c.653G>A/с.258+2T>C (р = 0,0452 и р = 0,0347).
Стойкая стеаторея с рождения должна являться показанием для проведения исследования кала на эластазу, которое является чувствительным и специфичным методом оценки экзокринной недостаточности ПЖ. При низкой активности эластазы кала требуется назначение ферментозаместительной терапии панкреатином в минимикросферах в адекватной дозе — от 2000 до 8000 ЛЕ/кг/сутки (средняя доза — 5,97 ± 2,47 ЛЕ/кг/сутки), разделенной на кратность приема пищи[22].
Мы не нашли публикации о наличии пищевой аллергии/непереносимости у пациентов с СШД. У обследуемых нами детей в 59,5% случаев ведущим симптомом на первом году жизни стал атопический дерматит, который носил распространенный характер и на фоне иммунодефицита осложнялся вторичным инфицированием. Как правило, атопический дерматит в сочетании с симптомами мальабсорбции расценивался педиатрами как проявление гастроинтестинальной формы пищевой аллергии, и дети по несколько лет наблюдались с диагнозами атопического дерматита, пищевой аллергии.
На основании полученных нами результатов исследования мы разработали алгоритм выбора смеси у детей с СШД (см. рис. 2), что позволило нам купировать клинические проявления аллергии на БКМ, провести коррекцию белково-энергетическая недостаточности (р = 0,0464) и снизить дозу панкреатина в минимикросферах (р = 0,0433).
Следует отметить, что СШД — это врожденное генетическое заболевание со стойким расстройством функций организма, при нем необходимо получение статуса инвалидности. Смесь Алфаре Гастро — единственная высокогидролизованная смесь с рождения, входящая в перечень специализированных продуктов лечебного питания для детей-инвалидов (Распоряжение Правительства РФ от 17 сентября 2024 г. № 2562-р)1, что обеспечивает возможность получения ребенком смеси на безвозмездной основе.
ЗАКЛЮЧЕНИЕ
Наше исследование показало, что пациенты с СШД нуждаются в тщательном контроле физического развития. Патогномоничными для данного синдрома являются задержка физического развития и экзокринная недостаточность ПЖ, что согласуется с данными других исследований.
Детям с СШД при отсутствии положительной динамики массо-ростовых показателей на фоне высоких доз панкреатина в минимикросферах, а также при наличии атопического дерматита и других симптомов пищевой аллергии и/или непереносимости необходимо назначение лечебного питания.
В качестве лечебного питания можно рекомендовать смеси Альфаре, которые имеют три формы для дифференцированного подхода к терапии пищевой аллергии для детей с рождения: в случае изолированных кожных проявлений, без выраженных симптомов мальабсорбции — Альфаре Аллерджи, при гастроинтестинальных проявлениях аллергии на БКМ в сочетании с мальабсорбцией, лактазной недостаточностью — Альфаре Гастро, при тяжелой аллергии на БКМ — Альфаре Амино.
Показания к применению данных лечебных смесей, помимо мальабсорбции и недостаточности питания, включают аллергию на БКМ, атопический дерматит, что помогает педиатру при выборе смеси в случае проявлений аллергии на БКМ у ребенка с СШД.







